aus dem Paracelsus Magazin: Ausgabe 3/2014
Das kutane Fettgewebe – ein endokrines Organ: Neue Strategien zur Behandlung von Cellulite
 Zwischen 40 und 120 Milliarden Fettzellen hat ein Erwachsener, je nach Leibesfülle. Das Fettgewebe der Haut ist bei der Entstehung der Cellulite mitbeteiligt. Es dient nicht nur der Thermoregulation, als Energiereservoir und mechanischer Puffer, sondern ist auch ein endokrines Organ, eine chemische Fabrik, die mehr als 100 Wirkstoffe produziert, u.a. das Cortisol, das einen wichtigen Impuls für die Neubildung von Fettzellen (Adipozytendifferenzierung) in der Haut liefert. Glycyrrhetinsäure aus der Süßholzwurzel (Lakritz) kann kutanes Fettgewebe abbauen, indem es in den Stoffwechsel des Hormons Cortisol eingreift. (1) Da das Fettgewebe der Haut die Körperoberfläche modelliert, konnte ein neues Therapieprinzip bei Cellulite entwickelt werden, das das Hautrelief verbessert. Weitere Untersuchungen müssen zeigen, ob die Glycyrrhetinsäure auch zur Behandlung des Lipödems geeignet ist.
Zwischen 40 und 120 Milliarden Fettzellen hat ein Erwachsener, je nach Leibesfülle. Das Fettgewebe der Haut ist bei der Entstehung der Cellulite mitbeteiligt. Es dient nicht nur der Thermoregulation, als Energiereservoir und mechanischer Puffer, sondern ist auch ein endokrines Organ, eine chemische Fabrik, die mehr als 100 Wirkstoffe produziert, u.a. das Cortisol, das einen wichtigen Impuls für die Neubildung von Fettzellen (Adipozytendifferenzierung) in der Haut liefert. Glycyrrhetinsäure aus der Süßholzwurzel (Lakritz) kann kutanes Fettgewebe abbauen, indem es in den Stoffwechsel des Hormons Cortisol eingreift. (1) Da das Fettgewebe der Haut die Körperoberfläche modelliert, konnte ein neues Therapieprinzip bei Cellulite entwickelt werden, das das Hautrelief verbessert. Weitere Untersuchungen müssen zeigen, ob die Glycyrrhetinsäure auch zur Behandlung des Lipödems geeignet ist.
Als Cellulite bezeichnet man das Nebeneinander von Vorwölbungen und Dellen an der Hautoberfläche, insbesondere an Oberschenkeln, Hüfte und Gesäß. Die Cellulite ist eine Beschreibung für einen Hautzustand und keine Erkrankung. Eine wesentliche Rolle für die Entstehung spielt das kutane Fettgewebe. Die Neubildung von Fettzellen (Adipogenese) ist ein biologisch hochkontrollierter Prozess und wird seit mehr als 25 Jahren intensiv erforscht. Die Fettvorläuferzellen erhalten u.a. durch hormonelle und ernährungsbedingte Faktoren Signale für den Übergang in Fettzellen (Adipozytendifferenzierung). Auch die Zell-Zell-Kommunikation ist in die Neubildung von Fettzellen involviert. Das Gleichgewicht zwischen Neubildung, Wachstum und Auflösung (Apoptose) der Fettzellen bestimmt das gesamte Körperfett. Die zwischen Kutis und Körperfaszie gelegene Subkutis besteht weitgehend aus einer bis zu mehreren Zentimetern dicken Schicht von Fettgewebe und modelliert damit die Körperoberfläche.
Das Lipödem ist eine Erkrankung bei Frauen, charakterisiert durch eine Unterhautfettvermehrung vorwiegend der Beine mit Ödemen, Spannungs- und Druckschmerzen sowie Hämatomneigung. Als Therapien kommen manuelle Lymphdrainage, Kompression und Krankengymnastik sowie Liposuktion infrage. Das Unterhautfettvolumen beim Lipödem ist – im Gegensatz zu dem beim Übergewicht – nicht abhungerungsfähig. Beim Lipödem histologisch auftretende Veränderungen sind vermehrte und hypertrophe Fettzellen. Es zeigt sich im Interstitium ein hoher Gehalt kapillarer Blutgefäße. (2) Interessant ist die Fragestellung, ob ein Fettabbau mittels Glycyrrhetinsäure in den frühen Phasen (Phase 1 und 2) des Lipödems das Fortschreiten der Erkrankung hemmen kann – der Beweis muss aber in weiteren Studien noch erbracht werden.
Die Dicke der Subkutis ist unterschiedlich und von verschiedenen Faktoren abhängig. Ihr Gesamtgewicht beträgt normalerweise zwischen 20 und 25 kg! Sie enthält zwischen 50 und 65% der Gesamtfettmasse des Organismus. Fettgewebe kommt im Körper um fast alle Organe herum vor. Es ist aber vor allem in der Subkutis vorhanden, wo es ein Fettpolster bildet. Die Verteilung der Fettpolster ist bei Mann und Frau verschieden:
Beim Mann dominiert es in der oberen Körperhälfte, vor allem am Bauch.
Bei der Frau ist es vor allem im unteren Bereich des Körpers unterhalb des Nabels an Becken, Gesäß und Oberschenkeln lokalisiert.
Adipozytenregulation und Wachstum
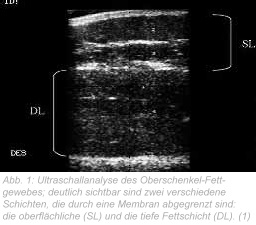 Das Fettgewebe beinhaltet verschiedene Zelltypen. Nur ein Drittel des Fettgewebes besteht aus Adipozyten. Weitere Bausteine sind u.a. Fibroblasten, Makrophagen, Monozyten und Präadipozyten. Zwei Prozesse sind an der Bildung von Adipozyten beteiligt: Erstens die Bildung von Präadipozyten aus mesenchymalen Stammzellen und zweitens die Umwandlung dieser in Fettzellen. (3) Hormonelle Aktivität und Transkriptionsfaktoren sind für die Adipozytendifferenzierung aus Präadipozyten verantwortlich. Bereits 1987 hatten Hauner und Mitarbeiter nachgewiesen, dass die Gabe von Cortisol oder anderer Corticosteroide in physiologischen Konzentrationen in Gegenwart von Insulin zu Stromazellen des Fettgewebes zu einer 30- bis 70-fachen Zunahme der Zahl sich entwickelnder Fettzellen führte. (4) Hauner züchtete vaskuläre Bindegewebszellen des kutanen Fettgewebes. In Gegenwart von 0,2 nM Triiodthyronin und 8,5 mikroMol Insulin differenzierten 25% der Zellen innerhalb von 18 Stunden zu Fettzellen, begleitet von einer Lipidakkumulation sowie einer Zunahme der Expression der Lipoproteinlipase und Glycyerol- 3-Phosphat-dehydrogenase. Cortisol konnte durch Dexamethason und teilweise durch Aldosteron ersetzt werden. Sexualhormone hatten keinen Effekt. (5)
Das Fettgewebe beinhaltet verschiedene Zelltypen. Nur ein Drittel des Fettgewebes besteht aus Adipozyten. Weitere Bausteine sind u.a. Fibroblasten, Makrophagen, Monozyten und Präadipozyten. Zwei Prozesse sind an der Bildung von Adipozyten beteiligt: Erstens die Bildung von Präadipozyten aus mesenchymalen Stammzellen und zweitens die Umwandlung dieser in Fettzellen. (3) Hormonelle Aktivität und Transkriptionsfaktoren sind für die Adipozytendifferenzierung aus Präadipozyten verantwortlich. Bereits 1987 hatten Hauner und Mitarbeiter nachgewiesen, dass die Gabe von Cortisol oder anderer Corticosteroide in physiologischen Konzentrationen in Gegenwart von Insulin zu Stromazellen des Fettgewebes zu einer 30- bis 70-fachen Zunahme der Zahl sich entwickelnder Fettzellen führte. (4) Hauner züchtete vaskuläre Bindegewebszellen des kutanen Fettgewebes. In Gegenwart von 0,2 nM Triiodthyronin und 8,5 mikroMol Insulin differenzierten 25% der Zellen innerhalb von 18 Stunden zu Fettzellen, begleitet von einer Lipidakkumulation sowie einer Zunahme der Expression der Lipoproteinlipase und Glycyerol- 3-Phosphat-dehydrogenase. Cortisol konnte durch Dexamethason und teilweise durch Aldosteron ersetzt werden. Sexualhormone hatten keinen Effekt. (5)
Heute weiß man, dass die Bildung von Fettzellen ein komplexer Prozess ist. Die Zunahme des Fettgewebes kann auf verschiedenartige Weisen erfolgen. Die Differenzierung von Präadipozyten ist ein streng regulierter Mechanismus, der durch die temporale Expression von Transkriptionsfaktoren gesteuert wird. Das Gleichgewicht zwischen Lipogenese und Lipolyse bestimmt die Menge an Lipidtropfen, die innerhalb des Fettgewebes gespeichert werden können. Letztendlich muss eine Zunahme des Fettgewebes das Ergebnis der Bereitstellung von Stammzellen für die Bildung von Präadipozyten sein, die in eine Kaskade von Proliferierung und Differenzierung mündet. Tomlinson und Stewart untersuchten, welche Rolle Glukokortikoide bzw. deren Prärezeptoren besitzen. Prärezeptor ist die mit den Glukokortikoid-Rezeptoren vergesellschaftete 11-ß-Hydroxysteroid-Dehydrogenase I (11-ß- HSDI), die die Bildung von Cortisol aus Cortison und umgekehrt steuert (6).
11-ß-Hydroxysteroid-Dehydrogenase I (11-ß-HSDI)
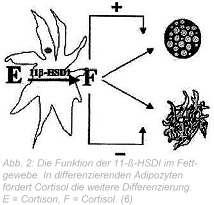 11-ß-HSDI gehören zur Gruppe der Short-Chain-Dehydrogenasen. Das Enzym besitzt zwei Isoformen. Typ I ist bidirektional, d.h., es besitzt Dehydrogenase- (Cortisol ins Cortison) und Reduktase- (Cortison ins Cortisol) Aktivität. Überwiegend fungiert das Enzym jedoch als Reduktase, um aktive Glukokortikoide zu generieren, z.B. aktives Cortisol aus Cortison. (7) Bisher ist nicht klar, welche Faktoren die Reaktionsrichtung des Enzyms bestimmen. Das Enzym wird in hohen Konzentrationen im Fettgewebe exprimiert, kommt aber auch in Gonaden, Knochen, Auge und Gehirn, besonders im Hippocampus vor. Die Expression der 11-ß-HSDI wird reguliert durch Wachstumsfaktoren, Cytokinen und pharmakologischen Wirkstoffen. Cytokine, wie Interleukin 1ß und TNF-α, sind potente Induktoren der Enzymaktivität und Expression. In Präadipozyten der Haut und des Omentums hemmt IGF-1α (Insulin-like-growth-factor-1=Peptid- Hormon als Differenzierungs- und Wachstumsfaktor, das durch Hormone, adrenale und ovarielle Hormone) und durch Nahrungsaufnahme (Fasten), Gewichtsreduktion, Sport und durch Stressreduktion stimuliert wird die Aktivität der 11-ß-HSDI und limitiert so die Verfügbarkeit des Cortisols an den Glukokortikoid- Rezeptoren. Cytokine, u.a. IL-1ß und TNF-α, sind starke Induktoren der Enzymaktivität und deren Expression. Auch Glukokortikoide erhöhen die Aktivität. Cortisol als Produkt der Enzymaktivität kann dadurch einen „Fast-Forward-Mechanismus“ bewirken, also eine Art „Autokatalyse“. (6) Bekanntlich kann Glukokortikoid-Exzess (Cushing-Syndrome) viszerale Fettleibigkeit, Dyslipidämien, Insulinresistenz und Bluthochdruck verursachen. Das Cushing-Syndrom ist allerdings selten und bei übergewichtigen Patienten ist meist der zirkulierende Glukokortikoid-Spiegel nur leicht erhöht. (9) Auf zellulärer Ebene können Glukokortikoide im menschlichen Fettgewebe aus inaktivem Cortison durch Oxo-Reduktase- Aktivität der 11-ß-HSDI generiert werden. (7) Transgene Mäuse mit einer Überproduktion der 11-ß-HSDI entwickeln eine viszerale Fettleibigkeit, Insulinresistenz, Fettstoffwechselstörungen und Bluthochdruck. In Präadipozyten sind Glukokortikoide essenziell für die Adipogenese und hemmen die Zellproliferation. Ausgereifte Adipozyten exprimieren späte Differenzierungsgene, die in den Lipidmetabolismus und den Lipidtransport involviert sind, wie die Glycyerol-3-phosphat-Dehydrogenase und das Fettsäure-Bindungsprotein. Viele dieser Gene werden durch Glukokortikoide gesteuert. (8) Die nicht selektive Hemmung der 11-ß-HSDI kann in vitro die Adipozytendifferenzierung hemmen. (10)
11-ß-HSDI gehören zur Gruppe der Short-Chain-Dehydrogenasen. Das Enzym besitzt zwei Isoformen. Typ I ist bidirektional, d.h., es besitzt Dehydrogenase- (Cortisol ins Cortison) und Reduktase- (Cortison ins Cortisol) Aktivität. Überwiegend fungiert das Enzym jedoch als Reduktase, um aktive Glukokortikoide zu generieren, z.B. aktives Cortisol aus Cortison. (7) Bisher ist nicht klar, welche Faktoren die Reaktionsrichtung des Enzyms bestimmen. Das Enzym wird in hohen Konzentrationen im Fettgewebe exprimiert, kommt aber auch in Gonaden, Knochen, Auge und Gehirn, besonders im Hippocampus vor. Die Expression der 11-ß-HSDI wird reguliert durch Wachstumsfaktoren, Cytokinen und pharmakologischen Wirkstoffen. Cytokine, wie Interleukin 1ß und TNF-α, sind potente Induktoren der Enzymaktivität und Expression. In Präadipozyten der Haut und des Omentums hemmt IGF-1α (Insulin-like-growth-factor-1=Peptid- Hormon als Differenzierungs- und Wachstumsfaktor, das durch Hormone, adrenale und ovarielle Hormone) und durch Nahrungsaufnahme (Fasten), Gewichtsreduktion, Sport und durch Stressreduktion stimuliert wird die Aktivität der 11-ß-HSDI und limitiert so die Verfügbarkeit des Cortisols an den Glukokortikoid- Rezeptoren. Cytokine, u.a. IL-1ß und TNF-α, sind starke Induktoren der Enzymaktivität und deren Expression. Auch Glukokortikoide erhöhen die Aktivität. Cortisol als Produkt der Enzymaktivität kann dadurch einen „Fast-Forward-Mechanismus“ bewirken, also eine Art „Autokatalyse“. (6) Bekanntlich kann Glukokortikoid-Exzess (Cushing-Syndrome) viszerale Fettleibigkeit, Dyslipidämien, Insulinresistenz und Bluthochdruck verursachen. Das Cushing-Syndrom ist allerdings selten und bei übergewichtigen Patienten ist meist der zirkulierende Glukokortikoid-Spiegel nur leicht erhöht. (9) Auf zellulärer Ebene können Glukokortikoide im menschlichen Fettgewebe aus inaktivem Cortison durch Oxo-Reduktase- Aktivität der 11-ß-HSDI generiert werden. (7) Transgene Mäuse mit einer Überproduktion der 11-ß-HSDI entwickeln eine viszerale Fettleibigkeit, Insulinresistenz, Fettstoffwechselstörungen und Bluthochdruck. In Präadipozyten sind Glukokortikoide essenziell für die Adipogenese und hemmen die Zellproliferation. Ausgereifte Adipozyten exprimieren späte Differenzierungsgene, die in den Lipidmetabolismus und den Lipidtransport involviert sind, wie die Glycyerol-3-phosphat-Dehydrogenase und das Fettsäure-Bindungsprotein. Viele dieser Gene werden durch Glukokortikoide gesteuert. (8) Die nicht selektive Hemmung der 11-ß-HSDI kann in vitro die Adipozytendifferenzierung hemmen. (10)
 Fazit
Fazit
Ohne Cortisol können sich keine Adipozyten bilden. Eine erhöhte Aktivität der 11-ß-HSDI während der Adipozytendifferenzierung sichert die Bereitstellung von Cortisol und damit die kontinuierliche Adipozytendifferenzierung.
Bereits 1999 konnten Bujalska und Mitarbeiter nachweisen, dass durch die Hemmung der 11-ß-HSDI durch Glycyrrhetinsäure aus der Süßholzwurzel die Aktivierung von Cortisol aus Cortison gehemmt werden kann (10), deren Prärezeptoren sie besitzen. Als Prärezeptor ist die 11-ß-HSDI mit den Glukokortikoid-Rezeptoren vergesellschaftet und reguliert die Bildung von Cortisol aus Cortison und umgekehrt (4).
Erscheinungsbild der Cellulite
Ultraschalluntersuchungen der von Cellulite betroffenen Hautzelle zeigen eine diffuse Vorwölbung von Fettzellen in die Dermis. Frauen zeigen ein diffuses Muster irregulärer und unterbrochener Bindegewebszüge direkt unterhalb der Dermis auf; bei Männern ist diese Schicht glatt und durchgehend. Bei Frauen besteht die obere Subkutisschicht aus stehenden Fettzellkammern, die durchs Bindegewebe röhrenförmig voneinander getrennt sind. Diese Fetteinheiten wölben sich beim seitlichen Zusammenpressen der Haut polsterartig hoch. Das entstehende Hautrelief ähnelt einer gesteppten Matratze oder der Oberfläche einer Orange (Orangenhaut). Mit zunehmendem Lebensalter vergrößern sich die Fettzellen. Mit der Glycyrrhetinsäure aus der Süßholzwurzel gelang es, nicht nur die Zahl der Adipozyten, sondern auch deren Größe zu verringern.
 Glycyrrhetinsäure ist der Hauptinhaltsstoff der Süßholzwurzel, die den Grundstoff für die Lakritzherstellung liefert. Glycyrrhetinsäure gehört zur Gruppe der Triterpensaponine vom ß-Amyrin-Typ. Von medizinischem Interesse ist das Glycyrrhizin, das Calcium- und Kaliumsalz der Glycyrrhizinsäure, das mit einer 50-fach stärkeren Süßkraft als Rohrzucker zugleich das süß schmeckende Prinzip und damit wertbestimmender Bestandteil von Lakritze ist. In jüngster Zeit finden glycyrrhetinsäurehaltige Salbenzubereitungen Anwendung zur Therapie der atopischen Dermatitis. In der Kosmetik werden Süßholzwurzel-Präparate zur Vermeidung von Hautentzündungen und zur Vorbeugung von Hautirritationen verwendet. Die lipophile Fraktion der Süßholzwurzel wird als Bleichcreme verwendet. Ein Zusatz von Glycyrrhizinsäure zu Arzneiformen für die äußerliche Anwendung kann ebenfalls deren Wirksamkeit verbessern, wie z.B. zu Idoxuridin, erstens aufgrund der antiviralen Eigenwirkung und zweitens als Resorptionsverbesserer für Idoxuridin.
Glycyrrhetinsäure ist der Hauptinhaltsstoff der Süßholzwurzel, die den Grundstoff für die Lakritzherstellung liefert. Glycyrrhetinsäure gehört zur Gruppe der Triterpensaponine vom ß-Amyrin-Typ. Von medizinischem Interesse ist das Glycyrrhizin, das Calcium- und Kaliumsalz der Glycyrrhizinsäure, das mit einer 50-fach stärkeren Süßkraft als Rohrzucker zugleich das süß schmeckende Prinzip und damit wertbestimmender Bestandteil von Lakritze ist. In jüngster Zeit finden glycyrrhetinsäurehaltige Salbenzubereitungen Anwendung zur Therapie der atopischen Dermatitis. In der Kosmetik werden Süßholzwurzel-Präparate zur Vermeidung von Hautentzündungen und zur Vorbeugung von Hautirritationen verwendet. Die lipophile Fraktion der Süßholzwurzel wird als Bleichcreme verwendet. Ein Zusatz von Glycyrrhizinsäure zu Arzneiformen für die äußerliche Anwendung kann ebenfalls deren Wirksamkeit verbessern, wie z.B. zu Idoxuridin, erstens aufgrund der antiviralen Eigenwirkung und zweitens als Resorptionsverbesserer für Idoxuridin.
Ein pflanzlicher Inhaltsstoff bringt Fettgewebe zum Schmelzen
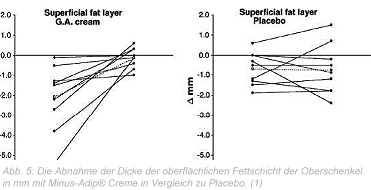
Eine Innovation auf dem Gebiet der pflegenden Kosmetik ist Wissenschaftlern des Instituts für Endokrinologie in Padua, Italien, gelungen. Aus den bisher aufgezeigten Pathomechanismen der Adipogenese ergab sich die logische Konsequenz, Hemmstoffe der 11-ß-HSDI einzusetzen, um die Cortisolkonzentrationen im kutanen Fettgewebe zu senken und damit einen Stimulus für die Adipozytendifferenzierung zu blockieren. Tatsächlich gelang es Armanini und Mitarbeitern mithilfe einer glycyrrhetinsäurehaltigen Creme, die Biosynthese des Cortisols im kutanen Fettgewebe zu hemmen. Eine nachweisbare Reduzierung der Zahl und Größe der kutanen Fettzellen führt zu einem sichtbar straffen und glatten Erscheinungsbild der Haut. Anhand von Penetrationsstudien war der Nachweis bereits gelungen, dass bei der Anwendung der Glycyrrhetinsäure über die Haut der Wirkstoff in tiefer gelegenen Hautschichten wiederzufinden ist. (11) In einer Studie konnte bei Frauen im Alter zwischen 20 und 33 Jahren mit normalem BMI mit einer 0,25%igen glycyrrhetinsäurehaltigen Creme nach ca. vier Wochen eine deutliche Abnahme des kutanen Fettgewebes gegenüber Placebo festgestellt werden. (1)
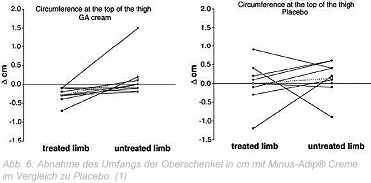
Fazit
Das kutane Fettgewebe ist ein endokrines Organ. Es produziert Hormone, die die Neubildung von Fettgewebe fördern. Es prägt das Hautrelief der Haut und ist damit an der Entstehung der Cellulite beteiligt. Mit der Minus-Adip® Creme, einer kosmetischen Neuinnovation, ist es gelungen, die Neubildung des kutanen Fettgewebes zu hemmen und so die Oberflächenstruktur der Haut zu beeinflussen. Weitere Untersuchungen müssen zeigen, ob eine Anwendung beim Lipödem erfolgversprechend ist.

Jens Bielenberg
Apotheker
Literatur
(1) D. Armanini, D. Nacamulli, F. Francini- Pesenti, G. Battagin, E. Ragazzi, C. Fiore: (2005) Glycyrrhetenic acid, the active principle of licorice, can reduce the thickness of kutaneous thigh fat through topical application. Steroids 8: 538-42
(2) W. Schmeller, Meier-Vollrath: Lipödem- Aktuelles zu einem weitgehend unbekannten Krankheitsbild. Akt Dermatol 2007, 33: 1-10
(3) G. Löffler, H. Hauner: (1987) Adipose tissue developement: The role of precursor cells and adipogenetic factors. PartII: The regulation of the adipogenic conversion by hormones and serum factors. Klin Wochenschr 17: 812-7
(4) H. Hauner, P. Schmid, EF Pfeiffer: (1987) Glukokortikoids and insulin promote the differetiation of human adipocyte precursor cells into fat cells. J Clin Endocrinol Metab 4: 832-5
(5) H. Hauner, G. Entenmann, M. Wabitsch, D. Gaillard, G. Ailhaud, R. Negrel & EF. Pfeiffer: (1989) Promoting effect of Glukokortikoids on the differentiation of human adipocyte precursor cells cultured in a chemically defined medium. J Clin Invest 84: 1663-1670
(5) PM. Jamieson, BR. Walker, KE. Chapmen KE, R. Andrew, S. Rossiter, JR. Seckl: (2000) 11-ß-Hydroxysteroiddehydrogenase type 1 is a predominant 11-ß-Reduktase in the intact perfused rat liver. J Endocrinol 3: 685-693
(6) JW. Tomlinson, PM. Stewart: (2002) The Functional Consequences of 11ß-Hydroxysteroid Dehydrogenase Expression in Adipose tissue. Horm Metab Res 34: 746-751
(7) R. Fraser, MC. Ingram, NH. Andersen, C. Morrison, E. Davies, JM. Connell: (1999) Corisoleffects on body mass, blood pressure and cholesterol in the general population. Hypertension 33: 1354-68
(8) H. Masuzaki, J. Paterson, H. Shinyama, NM. Morton, JJ. Mullins, JR. Seckl, JS. Flier: (2001) A transgenic model of visceral obesity and the metabolic syndrome. Science 294: 2166-70
(9) IJ. Bujilska, S. Kumar, PM. Stewart: (1997) Does central obesity reflect cushing syndrome in Omentum? Lancet 349: 1210-13
(10) IJ. Bujilska, S. Kumar, PM. Stewart: (1999) Differentiation of adipose stromal cells: the roles of Glukokortikoids and 11ß-hydroxysteroid dehydrogenase. Endocrinology 140: 3188-3196
(11) M. Frauen: (2001) Analytik kosmetisch wirksamer Pflanzenextrakte mit der Flüssigchromatographie-Massenspektrometrie-Dissertation Hamburg
zurück zur Übersicht dieser Ausgabe