| Die Mariendistel, botanischer Name Silybum marianum Gaertner, wächst an sonnigen und trockenen Hängen Südeuropas und Nordafrikas. Sie ist aber auch in trockenen Landstrichen Südamerikas und Südaustraliens zu finden. Zum ersten Mal erwähnt wird die Mariendistel im 4. Jahrhundert vor Christus vom Griechen Theophrastus. Dioskurides vermischte die Wurzeln mit vergorenem Honigsaft und setzte sie als Brechmittel bei Vergiftungen ein. Die heutige Gattungsbezeichnung Silybum geht auf das griechische Wort Sillybon zurück, was Quaste oder Anhängsel bedeutet und sich auf die Wurzel bezieht. Wie um viele in der traditionellen Volksmedizin angewandte Pflanzen spinnt sich auch um die Mariendistel ein Netz von Sagen. So weiß eine Legende zu berichten, daß das fränkische Heer von einer Epidemie heimgesucht wurde. Ein Engel habe den Kaiser durch ein Wunder auf die Mariendistel als Heilpflanze aufmerksam gemacht. Im 10. Jahrhundert soll Achius, ein sagenhafter König von Schottland, einen Ritterorden gegründet haben, der die Mariendistel als Wappenblume trug.
Wie häufig in der mittelalterlichen Medizin entschied die Form und das Aussehen (Signaturenlehre) einer Pflanze auch über deren Anwendung. So glaubte man, daß die Mariendistel wegen ihrer stacheligen Blüten und Blätter bei Seitenstechen gute Dienste leisten würde. Diese Indikation fand sich bei vielen Ärzten und Naturforschern wieder.
Der Arzt Albrecht von Haller (1755) erwähnt als erster eine Anwendung, die der modernen Therapie nahekommt. Er verwendete das Kraut bei Gebrechen der Leber. Der Samen der Mariendistel ist das Lebermittel von Johann Gottfried Rademacher, das gegen chronische Leber- und Milzleiden, akute Hepatitis mit Seitenstechen, Husten, blutigem Auswurf, Gelbsucht und Gallensteinkoliken angewandt wird. Ergebnisse der neueren medizinischen Forschung
Die ersten, die mit Versuchen an der Ratte die seit langem behauptete Leberschutzwirkung der Tinktur bestätigten, waren 1949 Eichler und Hahn. Seit 20 Jahren beschäftigt sich die neuere Forschung sehr intensiv mit der Mariendistel, aus deren Früchten durch Extraktion das pharmakologisch wirksame Silymarin gewonnen und daraus als Inhaltsstoffe das Silibinin, das Silidianin und Silicristin isoliert wurden, die chemisch in die Gruppe der Flavoligmane gehören. Dabei weist besonders Silibinin eine gute Leberschutzwirkung auf.
Der Gehalt an den verschiedenen Flavonolignanen und deren Verhältnis zueinander kann standortbedingt schwanken. Silymarin-Fertigarzneimittel, die aus Extrakten von Mariendistelfrüchten bestehen, enthalten 40-70% Silymarin mit einem Isomerenverhältnis Silibinin:Isosilibinin:Silichristin: Silidianin von ca. 3:1:1:1. Die Hauptkomponente ist immer Silibinin (Abb. 1). 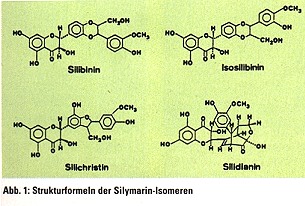 Pharmakologie Die Wirkung von Silymarin bzw. seinem isolierten Hauptisomer Silibinin wurde an einer großen Zahl von experimentellen Leberschädigungen nachgewiesen. Experimentelle Leberintoxikationen
Silymarin bzw. Silibinin antagonisieren erfolgreich akute Leberschädigungen, die durch Tetrachlorkohlenstoff, Gifte des Knollenblätterpilzes (Amanita phalloides), Ethanol, Galaktosamin, Thioacetamid, verschiedene Schwermetalle, bestimmte Arzneimittel und Umweltgifte, Frog Virus 3 und Escherichia coli-Endotoxin vorwiegend an Ratte und Maus hervorgerufen werden können. Es verhindert bzw. verringert auch experimentell induzierte Cholestasen (Tab. 1). | Intoxikation Tetrachlorkohlenstoff
(CCI4) Knollenblätterpilz-Gifte
Phalloidin
a-Amanitin Amanita phalloides
Lyophilisat Ethanol
Galaktosamin
Schwermetalle
Praseodymnitrat
Thallium
Arzneimittel
Paracetamol Umweltgifte
Benzpyren
Phosmet
Thioacetamid
Frog Virus 3
E. coli-Endotoxin
Cholestase
Mangan-Balirubin
Taurolithocholat
Phalloidin
Paracetamol
Östradiol | Tierart Ratte
Maus
Hund Maus
Maus
Ratte Maus
Hund
Ratte
Ratte Ratte
Ratte Maus
Ratte Maus
Ratte
Ratte
Maus
Ratte Ratte Ratte | Wirkung +
+
+ +
+
+ +
+
+
+ +
+ +
+ +
+
+
+
+ +
+ | Ein wichtiger Parameter zur Feststellung von Leberschädigungen ist die Erhöhung von Leberenzymen im Serum. Aus geschädigten Leberzellen können vermehrt Inhaltsstoffe austreten, was sich z. B. an einem Transaminasenanstieg (GPT, GOT) im Serum bemerkbar macht. Fast alle der in Tabelle 1 aufgeführten Leberschädigungen gehen mit einer erhöhten Aktivität von Leberenzymen im Serum einher. Silymarin senkt dosisabhängig die Transaminasen im Serum, d.h. es verhindert die Leberzellnekrosen.
Die häufigste Ursache von Lebererkrankungen beim Menschen ist der chronische Alkoholkonsum. In Abhängigkeit von der Dauer und Höhe der Alkoholzufuhr entwickelt sich ein fibrotischer Umbau der Leberzellen, der von einer Funktionsbeeinträchtigung begleitet wird und in der Leberzirrhose enden kann.
Stoffwechselveränderungen in der Leber werden durch Ethanol selbst und auch durch seinen toxischen, hochreaktiven Metaboliten, Acetaldehyd, hervorgerufen. Ethanol wird hauptsächlich über die Alkoholdehydrogenase (ADH) zum Acetaldehyd abgebaut. Ein zweiter Abbauweg, der durch hohe Alkoholdosen und vor allem bei chronischer Alkoholzufuhr stimuliert wird, verläuft über das mikrosomale Enzymsystem.
Ein dritter Weg von untergeordneter Bedeutung ist der Katalase-vermittelte Abbau.
Für Silymarin wurde nachgewiesen, daß es den Alkoholabbau über ADH und Katalase nicht beeinflußt, jedoch den Abbau über das mikrosomale Enzymsystem hemmt, so daß unter Silymarin mit einer geringeren Anflutung von Acetaldehyd in der Leberzelle zu rechnen ist. Der weitere Abbau von Acetaldehyd zum untoxischen Acetat wird zum einen über die Acetaldehyd-Dehydrogenase (ALDH) und zum anderen über eine AldehydOxidase katalysiert. Beim letzteren Weg entstehen hochreaktive Sauerstoffradikale, die physiologischerweise durch das Enzym Superoxiddismutase (SOD) zum H202″neutralisiert” werden. Die weitere Entgiftung des Wasserstoffperoxids zu H20 übernimmt die Glutathion-Peroxidase (GSH-Px) durch Oxidation von Glutathion (GSH/GSSG). Bei Erschöpfung oder Überflutung der physiologischen Radikalfängersysteme binden die Radikale an Zelleiweiße und andere Makromoleküle, was letztlich zu Enzym-Inaktivierungen bzw. zu Membranzerstörungen durch Lipidperoxidationen führt. Da Silymarin ausgeprägte Radikalfängereigenschaften besitzt, kann es die physiologischen Radikalfängersysteme entlasten. So wird z. B. der Abfall des Glutathionspiegels in der Leber nach akuter Ethanolintoxikation durch Silymarin verhindert und das Verhältnis GSH/GSSG zugunsten des “nicht verbrauchten GSH” verschoben.
Das Verhältnis von Glutathion (GSH) zum oxidierten Glutathion (GSSG) ist in den meisten Zellen größer als 500. Bei Ratten- und Affenversuchen wurde unter Gabe von Ethanol sowie von anderen hepatotoxischen Substanzen wie Buthamin, Sulfoximin, Paracetamol und Tetrachlorkohlenstoff GSH vorwiegend in die oxidierte Form überführt und die Adenosylmethioninsynthetase gehemmt. In einem gesunden Menschen werden pro Tag 6-8 g Adenosylmethionin synthetisiert. Dabei entstehen 800 mg freie Methylgruppen. Diese Methylgruppen werden im Ramen von Transmethylierungen auf Hormone, Neurotransmitter, Nukleinsäuren, Proteine usw. übertragen. S-Adenosylmethionin (SAM) spielt eine wichtige Rolle bei der Biosynthese von Phospholipiden, auch in der Zellmembran. In der Gehirnzellmembran reguliert SAM bioelektrische Vorgänge und die Aufrechterhaltung der Membranflüssigkeit, deren Verlust bei Tierversuchen zum Verlust von dopaminergen, alpha- und betaadrenergen Bindungsstellen führen. SAM führt in der Cerebrospinalflüssigkeit zu einer Erhöhung der Spiegel von 5Hydroxyindolessigsäure und Homovanillinmandelsäure (Abb.2). 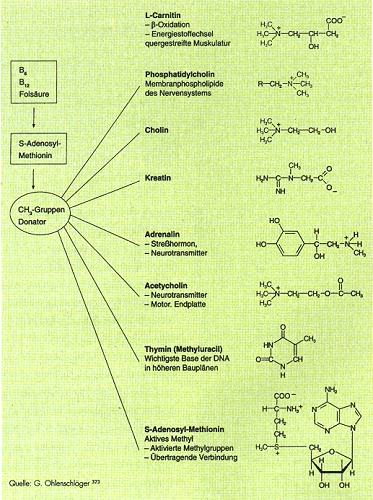 Mariendistelwirkstoff zur Behandlung von Leberintoxikationen durch Knollenblätterpilze |
| Wirkungsmechanismen von Silymarin
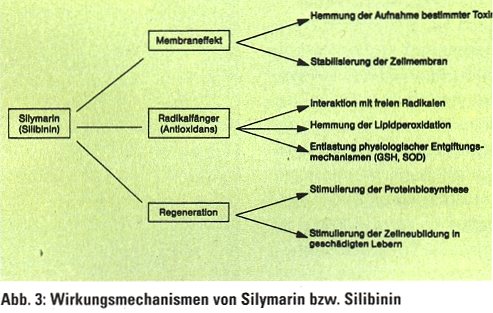
Worauf ist nun die positive Wirkung von Silymarin auf die Leber zurückzuführen? Nach dem bisherigen Stand der Kenntnis sind es im wesentlichen drei Wirkungsmechanismen: eine direkte Beeinflussung der Leberzellmembranen, eine Radikalfängerfunktion und eine Beschleunigung der Leberzellregeneration. Im folgenden soll auf diese drei Mechanismen näher eingegangen werden (Abb. 3): Membraneffekt
Silymarin kann die Aufnahme bestimmter Gifte in die Leberzelle verhindern. Dies betrifft spezifisch die Pilzgifte Phalloidin und Amanitin. Offensichtlich werden durch Silymarin Bindungsstellen bzw.Transportsysteme dieser Gifte an der Zellmembran blockiert, sodaß sie nicht mehr in die Zelle eindringen können bzw. ihr enterohepatischer Kreislauf unterbrochen wird. Radikalfängerfunktion
In zellfreien Systemen wurde gezeigt, daß Silymarin mit einer Vielzahl von oxidierenden und reduzierenden Radikalen, u.a. mit Sauerstoff- und Hydroxyl-Radikalen, reagieren kann. Silibinin bildet mit diesen Radikalen Zwischenprodukte, die eine geringere Reaktivität und längere Lebensdauer aufweisen.
Toxische Radikale entstehen in der Leber bei einer Vielzahl von physiologischen Stoffwechselprozessen. Vermehrt werden sie bei der Verstoffwechslung vieler hepatotoxischer Substanzen gebildet. Über Radikalkettenprozesse werden Lipidperoxidationen eingeleitet. Aufgrund seiner Radikalfängereigenschaften kann Silibinin die Kettenreaktionen unterbrechen und damit die Membranschädigungen vermeiden. Dies zeigt sich daran, daß Silymarin bzw. Silibinin die Bildung von Lipidperoxidationsprodukten wie Malondialdehyd oder die erhöhte Sauerstoffaufnahme, die mit der Lipidperoxidation einhergeht, in der Leber hemmt.
Zu den wichtigsten physiologischen Radikalfängern gehören GSH und SOD, die jedoch bei entsprechender Fremdstoffbelastung erschöpft werden können. Daß Silymarin die physiologischen Entgiftungsmechanismen entlasten kann, ist daran zu erkennen, daß unter einer Silymarinbehandlung derToxin-induzierte Glutathionabfall in der Leber vermindert wird. Regeneration
Silibinin ist nicht nur mit den Membranen der Leberzelle assoziiert, sondern akkumuliert auch in den Zellkernen. Dort stimuliert es die Aktivität der Polymerase – und damit die Transkription von ribosomaler RNS (rRNS). Es werden vermehrt Ribosomen gebildet, an denen zusammen mit der messenger RNS (mRNS) und der transfer RNS (tRNS) die Proteinsynthese abläuft. Je mehr Ribosomen vorhanden sind, desto mehr Proteine können gebildet werden, d.h. Silibinin beschleunigt die Proteinsynthese der Leberzelle. Die Stimulierung der Proteinsynthese ist eine wesentliche Voraussetzung dafür, daß von Toxinen geschädigte bzw. funktionslos gewordene Enzyme und Strukturproteine ersetzt werden, d. h. es erfolgt eine schnellere Normalisierung des gestörten Stoffwechsels und der Membranintegrität. Fazit
Zahlreiche Studien belegen die Wirksamkeit von Mariendistelextrakten bei toxischen Lebererkrankungen und höhere Überlebenschancen bei Leberzirrhosen alkoholischen Ursprungs. Jüngere Studien am Max-Planck-Institut für Biochemie ergaben nach zehnjähriger intensiver Forschungsarbeit, daß Silymarin die Stimulation bestimmter Stoffwechselprozesse in der Leberzelle fördert und die normalen Leberfunktionen wiederherstellt.
Durch seine Radikalfänger-Funktion entlastet Silymarin den Glutathionverbrauch in der Leberzelle mit dem Korrelat eines höheren Glutathion (GSH)/Glutathion ox. (GSSG)-Quotienten. Das Glutathion ist nicht nur in den Stoffwechsel der Prostaglandine involviert, sondern steuert die Aktivität der Adenosylmethionin-synthese, die den Pool übertragbarer Methylgruppen in Form des Adenosylmethionins reguliert und so zahlreiche Stoffwechselpro-zesse wie den Methylierungsgrad der DNS sowie die Leberfunk-tion und den Gallenfluß moduliert.
Die Verträglichkeit von Silymarin, wie sie sich auch aus anderen klinischen Studien und den Spontanmeldungen ergibt, ist als gut zu bezeichnen. Mit Silymarin steht damit zur Behandlung chronischer Lebererkrankungen toxischen Ursprungs ein Phytopharmakon zur Verfügung, dem ein besonderer Stellenwert zukommt, da Silymarin für ein Lebertherapeutikum ganz wesentliche Eigenschaften aufweist, nämlich Radikalfänger-Funktion, Stabilisierung der Leberzellmembranen und Förderung der Leberregeneration. Begriffserklärungen:
Transaminasen:
Enzyme, die Aminogruppen von einer Substanz auf die andere übertragen und die wichtige Funktionen im Eiweißstoffwechsel haben.
Bilirubin:
Abbauprodukt des Häms (Farbstoffanteil des Hämoglobins) von gelbbraunroter Farbe. Bei erhöhter Konzentration kann es zum Übertritt ins Gewebe kommen – Gelbsucht -.
Kreatinin:
Ausscheidungsform des Kreatins, einem Zwischenprodukt des Stoffwechsels, das in Leber und Niere gebildet wird. Die Ausscheidung des Kreatinins ist ein wichtiger Parameter für die Nierendiagnostik.
Quickwert:
Synonym für Prothrominzeit, Thromboplastinzeit. Gemessen wird die Zeit bis zum Eintreten der Blutgerinnung unter bestimmten Bedingungen. Der Quickwert kann verlängert sein bei bestimmten Lebererkrankungen. | Verlauf einer Knollenblätterpilzvergiftung: | | Die Knollenblätterpilzvergiftung ist gekennzeichnet durch 4 voneinander abgrenzbare Krankheitsphasen: -
In der Latenzzeit von 6 bis maximal 48 Stunden – im Mittel 6-12 Stunden nach der Pilzmahlzeit – sind die Vergifteten symptomlos. -
Hieran schließt sich die gastrointestinale Phase mit einer Dauer von 12-24 Stunden. In dieser Zeit sind folgende Symptome feststellbar: Erbrechen und cholera-ähnliche Durchfälle, evtl. mit Blutbeimengungen, Magenschmerzen, Blutdruckabfall. -
Es folgt eine zweite scheinbare Latenzzeit mit einer Dauer von 12-24 Stunden. Normalisierung von Ph-Wert, Anstieg von Transaminasen, Bilirubin, Kreatinin, Abfall von Quickwert, Abklingen der gastrointestinalen Symptomatik, aber: Anschwellen der Leber. -
Fulminantes Leberversagen aufgrund akuten Leberzellzerfalls. Schädigung des Zentralnervensystems. Nierenversagen. Exitus infolge innerer Blutungen. (Aus:”Legalon SIL – Zur Behandlung von Leberintoxikationen durch Knollenblätterpilze”) Achtung: Jeder Brechdurchfall, der durchschnittlich 12 Stunden – exakt 6-48 Stunden – nach einem Pilzessen auftritt, ist in höchstem Maß verdächtig auf eine Knollenblätterpilzvergiftung. Dr. Karl Hruby-Wiener Vergiftungsinformationsteil | Autor:
Apotheker Jens Bielenberg
Sandkuhle 3
25524 Itzehoe
Tel.: 04821-63060 |