
Neue Erkenntnisse zum Ausgleich von Eisenmangel
Trotz des beginnenden Frühlingserwachens bringt diese Jahreszeit für manche Menschen eine unerklärliche Müdigkeit und ein Gefühl der Energielosigkeit mit sich. Eisenmangel als eine der häufigsten Nährstoff-Defizienzen weltweit kann zu diesen Symptomen beitragen und den Start in die warmen Monate trüben. In diesem Artikel werfen wir einen Blick auf die Bedeutung von Eisen für unseren Körper. Von der Frühjahrsmüdigkeit bis hin zu einem Mangel an Motivation – hinter scheinbar alltäglichen Beschwerden können ernstzunehmende Ursachen stecken, die es zu verstehen und zu bewältigen gilt.
Tausendsassa Eisen
Neben seiner Funktion als sauerstoffbindendes Element im Hämoglobin der Roten Blutkörperchen dient Eisen in unterschiedlichen Ionenformen auch als Co-Faktor für viele enzymatische Reaktionen sowie zur Energiegewinnung in Mitochondrien, den „Kraftwerken der Zelle“. Letztlich ist der gesamte Energiestoffwechsel von einem adäquaten Angebot an Eisen abhängig.
Der Eisenstoffwechsel, der die Resorption, die Regulation und den Transport von Eisen beschreibt, stellt im Gegensatz zu anderen Mineralien wie Kalzium, Natrium und vielen weiteren Spurenelementen im Körper eine Besonderheit dar: Eisen kann nicht aktiv ausgeschieden werden und wird damit im Wesentlichen über die Aufnahme und eine Aufnahmeregulation gesteuert (1).
Die 4-5 g Eisen im menschlichen Körper und die Verluste über den Tag bei gesunden Menschen von ca. 0,5-1,5 mg/Tag können trotz der geringen Resorptionsquote von 6% (Männer) bis 12% (Frauen) (2) im Regelfall über die Nahrung kompensiert werden.
Durch den engen Bezug des Eisens zum Energiestoffwechsel in den Mitochondrien hat ein Mangel auch deutliche
Auswirkungen auf die Leistungsfähigkeit und kann folgende Symptome hervorrufen:
• Abgeschlagenheit
•
Blässe
• Müdigkeit
• Konzentrationsschwäche
• Infektanfälligkeit
• Weiße Rillen auf den
Fingernägeln
• Vermehrter Haarausfall
• Eingerissene Mundwinkel
• Kopfschmerzen
• Schwindel
Diese allgemein wirkenden Symptome und die oft fehlende Diagnostik führen häufig zur fehlenden Behandlung eines Eisenmangels.
Eisenmangel als globales Phänomen
Weltweit ist Eisenmangel die häufigste und weitverbreitetste nahrungsbedingte Unterversorgung (3). Epidemiologischen Zahlen der Eisenmangel-Anämien zeigen: Ein Viertel der Weltbevölkerung leidet an einer Eisenmangel-Anämie. Dabei sind am häufigsten Kinder im Vorschulalter mit über 47% betroffen. Männer hingegen zeigen mit knapp 13% die niedrigste Prävalenz (4).
Risikogruppen für einen latenten bis manifesten Eisenmangel bis hin zur Anämie sind dabei Menschen in Wachstumsphasen, also Kinder (5), vermehrter Verbrauch von Eisen), Frauen im reproduktiven Alter (vermehrter Verlust von Eisen während der Menstruation), Frauen während der Schwangerschaft (vermehrter Eisenverbrauch), stillende Frauen, Sportler (vermehrter Verbrauch), Menschen mit einer eisen- und Vitamin-C-armen Ernährung sowie solche, die Eisen im Rahmen z.B. entzündlicher Erkrankungen verbrauchen (6) (Abb. 1).
Auch ein Eisenmangel, der nicht mit einer Anämie einhergeht, stellt für den Organismus bereits ein Problem dar. Optimale Eisenwerte sind wichtig für Leistungsfähigkeit im Sport, aber auch im Alltag. Ein wichtiger Parameter zur diagnostischen Bestimmung ist der Eisenspeicherwert, das Serum-Ferritin (7). Dies allein reicht nicht aus: Transferrin und dessen Sättigung sollten neben der Standarddiagnostik ebenfalls Teil der Analysen sein, um zu differenzieren, ob bereits ein latenter Eisenmangel besteht, auch ohne Anämie, die aber Symptome von Müdigkeit, Erschöpfung und Energiemangel erklären könnte.
Eisenvorkommen
Neben Fehl- und Mangelernährung führen physiologische sowie pathophysiologische Prozesse dazu, dass Eisen unterschiedlich gut resorbiert werden kann.
Über die Nahrung aufgenommenes Eisen wird über einen Transportkanal in Darmepithelzellen (DMT 1) resorbiert. Dabei wird Eisen Fe2+ aufgenommen, kann aber auch in anderen Formen über spezifische Transportkanäle resorbiert werden. In tierischen Lebensmitteln, z.B. Fleisch, liegt es als Häm-Eisen gebunden vor, das über den HCP-1 Kanal aufgenommen werden kann (8). In Pflanzen enthaltenes Eisen liegt meistens als pflanzliches Ferritin (Speichereisen) vor, das ebenfalls über einen separaten Kanal resorbiert werden kann.
Einfluss der Hepcidin-Synthese
Liegt der Grund für den Mangel nicht in der Nahrung, so ist die Funktion der Resorption zu berücksichtigen und stellt eine mögliche Ursache dar. Die Resorptionsquote wird vom Organismus selbst reguliert und unter bestimmten Umständen gehemmt: Im Rahmen einer Entzündungssituation werden von Immunzellen vermehrt proentzündliche Botenstoffe (Zytokine) ausgeschüttet. Eines davon ist Interleukin 6. Durch die Blutzirkulation gelangen die Zytokine zur Leber, wo sie anregen, Hepcidin zu produzieren und auszuschütten. Dabei handelt es sich um ein Peptid, das die Aufgabe hat, die Eisenaufnahme zu regulieren bzw. zu hemmen, indem es an den Ferroportin-Kanal gebunden wird. Dieser sorgt dafür, Eisen aus Darmepithel-, Leber- und Immunzellen (Makrophagen) in den Blutkreislauf zu exportieren. Durch die Bindung von Hepcidin an Ferroportin verweilt das Eisen in den Zellen, ohne dass es für weitere Stoffwechselprozesse verwendet werden kann (9).
Eine evolutionäre Perspektive zeigt entgegen der kontraproduktiven Vermutung für den Organismus den Nutzen der Hepcidin-Synthese: Ein aktiviertes Immunsystem und damit eine erhöhte Interleukin-6-Ausschüttung bedeutete für unsere Vorfahren meist Pathogenbelastungen durch Bakterien. Auch sie benötigten Eisen für ihren Stoffwechsel (10). Fehlt Eisen, können sich Bakterien weniger vermehren, was im Umkehrschluss das Immunsystem befähigt, die Pathogene möglichst schnell zu bekämpfen, auch wenn es für den Organismus selbst bedeutet, dass Stoffwechselprozesse nicht oder nur schlechter ablaufen.
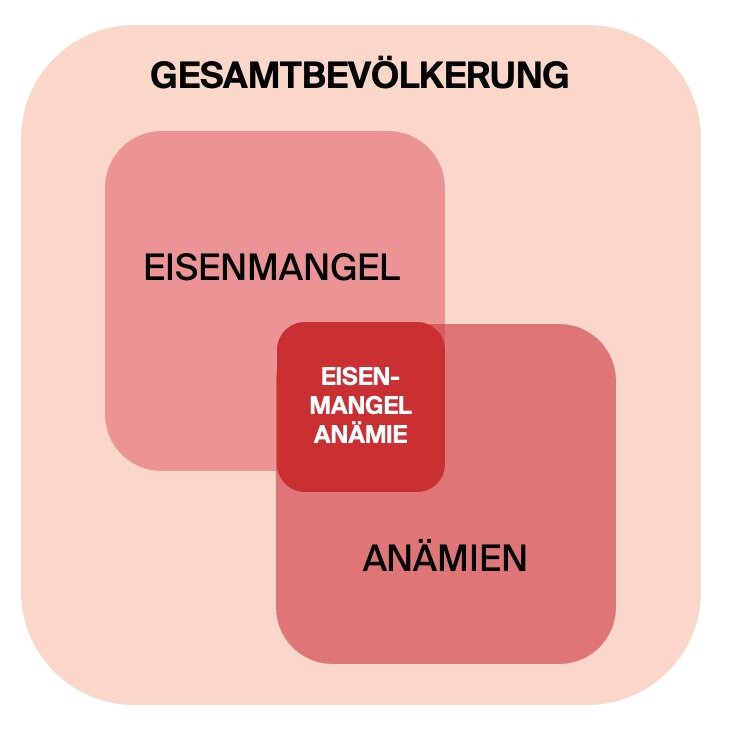
Abb. 1: Schnittmenge zwischen Eisenmangel und Anämien – Eisenmangel ist für die meisten Anämien weltweit verantwortlich
Problematische Aktivierungsmechanismen des Immunsystems
Dieser Schutzmechanismus zeigt sich aus heutiger Perspektive als problematisch: Aus Forschungszweigen wie der Psychoneuroimmunologie und der Stress-Forschung ist bekannt, dass auch andere Einflüsse das Immunsystem aktivieren können (11).
Dazu zählen:
• Lebensstil-Faktoren
• Proentzündliche Ernährung
• Bewegungsmangel
• Zu viel
Training
• Schlafmangel
• Umweltgifte
• Stress auch psychoemotional, chronisch
Diese Aktivierungen des Immunsystems werden auch als niedriggradige Entzündungssituationen bezeichnet, die sich nicht in einem akuten Infekt äußern, sondern eher ein chronisches Geschehen nach sich ziehen. Niedriggradige Entzündungen werden mit zahlreichen nicht-ansteckenden chronischen und degenerativen Krankheitsbildern der Zivilisation assoziiert (12).
Eine chronische Aktivierung des Immunsystems zieht im Umkehrschluss eine vermehrte Synthese von Hepcidin nach sich, und damit eine chronische Verteilungsstörung von Eisen, die auch zu entzündungsbedingten Anämien führen kann (13) (Abb. 2).
Ernährungsmaßnahmen bei Eisenmangel
An erster Stelle steht eine artgerechte und ausgewogene Ernährung. Viele Lebensmittel enthalten zwar Eisen, durch die verschiedenen Speicherformen zeigen sich aber Unterschiede in der Bioverfügbarkeit. Zusammensetzung und Bestandteile der Nahrung können ebenfalls deutliche Auswirkungen auf die Eisenresorption nehmen: Demnach haben verschiedene Pflanzenstoffe wie Phytate und Polyphenole gerade in Tee und Kaffee negative Auswirkungen auf die Eisenaufnahme. Gleiches gilt für Kalzium, z.B. aus Milch und Milchprodukten. Förderlich ist die Kombination von pflanzlichem Eisen mit Ascorbinsäure (Vitamin C), um die Aufnahme zu verbessern, da Vitamin C seine Umwandlung in eine nichtresorbierbare Form verhindert (14).
Neben- und Wechselwirkungen durch Eisen-Präparat-Einnahme
Reicht die zugeführte Menge an Eisen über die Nahrung nicht aus, sind Eisen-Supplementierungen medizinisch impliziert. Dabei werden freie Eisen-Präparate oral zugeführt. Doch das zweiwertige Eisen Fe2+ sorgt in den Darmzellen für die vermehrte Bildung Freier Radikale – sogenannte Radikaler Sauerstoff Indizes (ROS). Dabei entsteht durch die Zufuhr größerer Mengen u.a. freies Eisen in der zweiwertigen Form (Fe2+) eine Hydroxylradikalenbildung (Eisen und Wasserstoffperoxid reagieren). Diese Fenton-Reaktion sorgt dafür, dass für den weiteren Transport das Fe2+ in Fe3+ umgewandelt wird. Allerdings führen die bei der Reaktion entstehenden Freien Radikale in größeren Mengen zum programmierten Zelltod (15).
Die Anwesenheit eines Eisen-Chelators, also eines eisenbindenden Stoffes, kann diesen Prozess herunterregulieren (16). Vermehrter Zelltod führt zur Schädigung der Darmbarriere und ist mit weiteren Nebenwirkungen verbunden (17). Patienten, die Eisen-Präparate
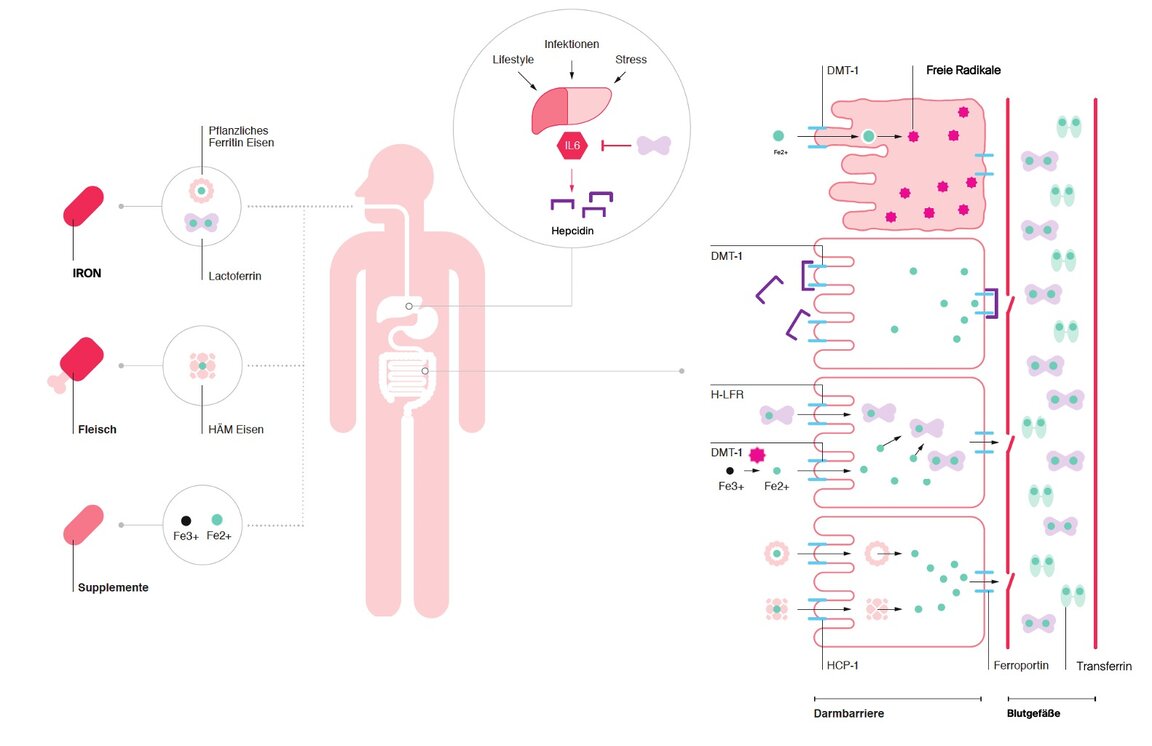
Abb. 2: Aufnahme, Verteilung, Regulation und Störfaktoren, die den Eisenhaushalt beeinflussen
verwenden, kennen diese Nebenwirkungen als Verstopfung, Übelkeit, Durchfall, Bauchschmerzen, Erbrechen, Sodbrennen und dunklen Stuhl (18). Um die Nebenwirkungen abzumindern, werden auch Präparate mit Fe3+ verwendet, die zwar besser in der Verträglichkeit sind, aber vor der Aufnahme zuerst in Fe2+ umgewandelt werden müssen, was die Bioverfügbarkeit verringert und Freie Radikale im Darmlumen bildet (19).
Neue Wege der Eisenregulation
Auf Basis einer Betrachtung der physiologischen Stoffwechselvorgänge des Eisenhaushaltes und systemischer Vorgänge im Organismus werden in wissenschaftlichen Untersuchungen neue Möglichkeiten zur Behandlung des Eisenmangels angedacht: Lactoferrin, ein eisenbindendes Glykoprotein, das von Immun- und Drüsenzellen gebildet wird, gehört zur Gruppe der Transferrine, stellt einen natürlichen Transporter für Eisen dar und kann Einfluss auf den Eisenhaushalt nehmen. Als Immunprotein nimmt es aber auch Einfluss auf die Infektabwehr, mit antibakteriellen, antiviralen und antimykotischen Eigenschaften (20). Lactoferrin ist ein Immunmodulator und kann die Funktionen des Immunsystems beeinflussen, bei Fehlfunktion sogar regulieren (21).
In größeren Mengen kommt Lactoferrin in der Milch von Säugetieren vor. Strukturell und funktionell ist das aus der Kuhmilch (bovine Lactoferrin) stammende im Vergleich zum humanem Lactoferrin nahezu identisch (22). Die Extraktion von Lactoferrin aus Kuhmilch stellt dabei die gängige Methode dar, um es für präventive und therapeutische Zwecke in größeren Mengen zur produzieren. Doch trotz oder gerade wegen der vielfältigen Eigenschaften und der hohen Reaktionsbereitschaft des Moleküls ist die Aufreinigung (Purifizierung) von maßgeblicher Bedeutung bezüglich der Funktionsweise, Bioverfügbarkeit und Wirkungsweise von Lactoferrin (bLF) im menschlichen Körper (23).
Einflussnahme auf die ursächlichen Mechanismen
Durch die antientzündlichen und immunmodulierenden Eigenschaften (24) werden Entzündungssituationen mit beeinflusst. Dabei werden bei chronischen Entzündungen ausgeschüttete Zytokine, wie Interleukin 6, das die Hepcidin-Synthese anregt, durch Lactoferrin herabreguliert, was bei in-vitro-Untersuchungen nachgewiesen wurde (25). Erste klinische Untersuchungen konnten diesen Prozess bestätigen. Dabei wurden schwangere Frauen mit Eisenmangelanämie beobachtet (26). Eine Metaanalyse aus 2022 konnte zeigen, das Lactoferrin bessere Auswirkungen auf Serumeisen, Serumferritin und Hämoglobinkonzentration zeigt als Eisensulfat, gleichzeitig eine reduzierende Wirkung auf die fraktionierte Eisenresorption und den Interleukin-6-Spiegel aufweist (27).
Fazit
Eisen ist entscheidend für unseren Energiestoffwechsel und unsere Vitalität. Eine ausgewogene Ernährung und ggf. ergänzende Maßnahmen können einem Mangel entgegenwirken. Neue Forschungsansätze wie die Nutzung von Lactoferrin zeigen vielversprechende Ergebnisse und könnten die Behandlungsmöglichkeiten in Zukunft verbessern.

Matthias Baum
Heilpraktiker mit Schwerpunkten klinische Psychoneuroimmunologie, funktionelle
Labordiagnostik, Mikronährstofftherapie, Ernährungsberatung, Darmgesundheit und Physiotherapie,
Gesundheitswissenschaftler, Dozent und Speaker
baum@gesundheitspraxis-altona.de
Literatur
(1) Vaulont S, et al: Of mice and men – The iron age. J Clin Invest. 2005;115(8):2079–2082.
(2) Kaltwasser JP, et
al: Eisenmangel und andere hypoproliferative Anämien. Harrisons Innere Medizin. Berlin. 2003:733.
(3) WHO: Iron Deficiency Anaemia Assessment, Prevention and Control – A guide for programme managers. 2001.
(4) Durrani AM: Prevalence of Anemia in Adolescents – A Challenge to the Global Health. Acta Scientific Nutritional Health.2018;2(4):24–27.
(5) Grant CC, et al: Population prevalence and risk factors for iron deficiency in Auckland, New Zealand. Journal of
Paediatrics and Child Health. 2007;43:532–538.
(6) Lee JO, et al: Prevalence and Risk Factors for Iron Deficiency
Anemia in the Korean Population – Results of the Fifth Korea National Health and Nutrition Examination Survey. Korean
Med Sci. 2014;29:224–229.
(7) Knovich MA, et al: Ferritin for the Clinician. Blood Rev. 2009 May;23(3):95–104.
(8) Sharp P, et al:
Molecular mechanisms involved in intestinal iron absorption. World J Gastroenterol. 2007 September
21;13(35):4716–4724.
(9) Cherayil BJ: Iron and Immunity – Immunological Consequences of Iron Deficiency and Overload. Arch. Immunol. Ther.
Exp. 2010;58:407–415.
(10) Andrews SC, et al: Bacterial iron homeostasis. FEMS Microbiology Reviews.
2003;27:215–217.
(11) Rohleder N: Stimulation of Systemic Low-Grade Inflammation by Psychosocial Stress. Psychosomatic Medicine. 2014;76:181–189.
(12) Liu YZ, et al: Inflammation – The Common Pathway of Stress-Related Diseases. Frontiers in Human Neuroscience.
2017 June:Article 316.
(13) Ganz T, et al: Iron imports – Hepcidin and regulation of body iron metabolism. Am J
Physiol Gastrointest Liver Physiol. 2006;290:199–203.
(14) Zijp IM, et al: Effect of Tea and Other Dietary Factors
on Iron Absorption. Critical Reviews in Food Science and Nutrition. 2000;40(5):371–398.
(15) Eid R, et al: Iron
mediated toxicity and programmed cell death – A review and a reexamination of existing paradigms. Biochimica et
Biophysica Acta. 2017;1864:399–430.
(16) Ward PP, et al: Lactoferrin – Role in iron homeostasis and host defense against microbial infection. BioMetals.
2004;17:203–208.
(17) Kortman G, et al: Nutritional iron turned inside out – intestinal stress from a gut
microbial perspective. FEMS Microbiol Rev. 2014;38:1202–1234.
(18) Tolkien Z, et al: Ferrous Sulfate Supplementation Causes Significant Gastrointestinal Side-Effects in Adults – A
Systematic Review and Meta-Analysis. POLS One. 2015.
(19) Behnisch W, et al: S1-Leitlinie 025-021 –
Eisenmangelanämie. AWMF online. 2016(1).
(20) Chen PW, et al: Influence of Bovine Lactoferrin on the Growth of Selected Probiotic Bacteria under Aerobic Conditions. Biometals. 2014;27(5):905–914.
(21) Puddu P, et al: Immunomodulatory effects of Lactoferrin on antigen presenting cells. Biochemie.
2009;91:11–18.
(22) Valenti P, et al: Lactoferrin – an important host defence against microbial and viral attack.
Cell Mol Life Sci. 2005;62:2576–2587.
(23) Moradian F: Lactoferrin, Isolation, Purification and antimicrobial
effects. Journal of Mazandaran University of Medical Sciences. 2011(8).
(24) Legrand D: Overview of Lactoferrin as
a Natural Immune Modulator. The Journal of Pediatrics. 2016:173.
(25) Cutone A, et al: Lactoferrin efficiently
counteracts the inflammation-induced changes of the iron homeostasis system in Macrophages. Frontiers in Immunology.
2017;6(8):Article 705.
(26) Paesano R, et al: The influence of Lactoferrin, orally administered, on systemic iron
homeostasis in pregnant women suffering of iron deficiency and iron deficiency anaemia. Biochimie. 2009;91:44–51.
(27) Zhao X, et al: Comparative Effects between Oral Lactoferrin and Ferrous Sulfate Supplementation on
Iron-Deficiency Anemia – A Comprehensive Review and Meta-Analysis of Clinical Trials. Nutrients. 2022;14(3):543.

